Gravimetria del sulfato de Bario
Objetivo: precipitacion cuantitativa del sulfato de Bario
Las sales de bario solubles reaccionan con el ácido sulfúrico o con los
sulfatos en medio acido, dando un precipitado blanco de sulfato de
bario, insoluble en el agua y en ácidos.
El método se basa en la precipitación del sulfato de bario, el cual es
escasamente soluble, la solubilidad del sulfato de bario en el agua es de
unos 3mg/lts a temperatura ambiente.
Materiales:
- vidrio de reloj
- vaso de precipitado
- estufa
- baño de arena
- papel whatman
- papel filtro
- papel de tornasol
- horno de secado
- crisol
Reactivos:
- cloruro de bario
- acido clorhidrico
- acido sulfurico
- agua destilada pura
Procedimiento:
1. En un vidrio de reloj, pesar 1 gramo de cloruro de bario
cristalizado BaCl2.H2O
? Luna de reloj: 37.3931g
? Peso del BaCl2.H2O.: 1,0368g
2. Disolver el cloruro de bario cristalizado en 30 ml de agua
destilada
3. Calentar la solución (casi a ebullición) entre 70-80°c
4. Así en caliente añadir a la solución 3ml. De ácido clorhídrico (HCl)
para que la precipitación sea en medio acido.
5. Antes de seguir adelante debemos tener preparado una solución
de H2SO4 al 2N , que se obtiene dejando caer 2ml de ácido
sulfúrico (d=1.84) sobre 50 ml de agua destilada
? Peso vaso precipitado=29.8585g
? Peso vaso + H2SO4 =33.3068g
? Peso H2SO4 =3.4483g
6. Luego calentar ambas soluciones a una temperatura promedio de
80°C
7. Comenzamos añadir poco a poco y agitando la solución acida,
últimamente preparada a la solución de bario, hasta que solo
quede pocos ml. de reactivo.
8. Dejar sedimentar el precipitado blanco de sulfato de bario
producido.
9. Sedimentado el precipitado; se agrega con precaución los últimos
ml. de reactivo, para comprobar si la precipitación acido total; si
observamos que sigue precipitado habría que añadir más
reactivo.
10. Nuevamente se deja sedimentar el precipitado , y se le introduce
en la estufa o baño de arena por espacio de 2 horas.
11. Luego se filtra a través de papel whatman de peso de cenizas
conocidas.
12. Procurando que el precipitado quede en el vaso, procedemos a
lavarlo con agua acidulada (1 o 2 gotas de H2SO4) por 2 o 3
veces ; luego con agua destilada pura ,pero en caliente.
13. Por último se vierte todo el precipitado en el filtro y se sigue
lavando hasta que las aguas no den reacción acida al papel de
tornasol.
14. El precipitado se traslada a la estufa para desecarlo por unos
15 minutos.
15. Luego procedemos a la calcinación del papel filtro y del
precipitado empleando un crisol
16. Llevar al horno por espacio de 30 minutos ,luego al desecador
para que sea enfrié
17. Finalmente hacer la pesada respectiva , y anotar el peso para
realizar los cálculos
CALCULOS:
Se descuenta el peso de crisol, obteniendo así el peso del sulfato de
bario.
Luego se hacen los cálculos para averiguar la cantidad y expresarlo en
porcentaje.
? Peso del BaCl2.H2O.: 1,0368g
? Peso H2SO4 =3.4483g
? Peso de precipitado=0.9688g
1. Determinar el porcentaje de ‘Ba’ como Ba???.

2. Determinar la composición del ?? ??? (% en peso y densidad).
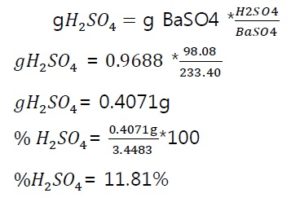
3. Determinar el porcentaje de ???.
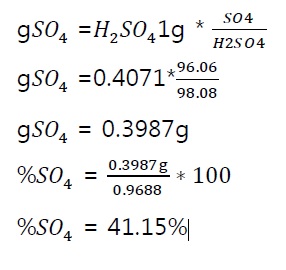
Fundamento en la determinación gravimétrica del Bario
Es para determinar lo soluble, cómo reacciona o como precipita y con qué precipita.
Los métodos gravimétricos se caracterizan porque lo que se mide en ellos es la masa. Como esta magnitud carece de toda selectividad, se hace necesario el aislamiento de la sustancia que se va pesar de cualquier otra especie, incluido el disolvente. Así pues, todo método gravimétrico precisa una preparación concreta de la muestra, con objeto de obtener una sustancia rigurosamente pura con una composición estequiométrica perfectamente conocida.






