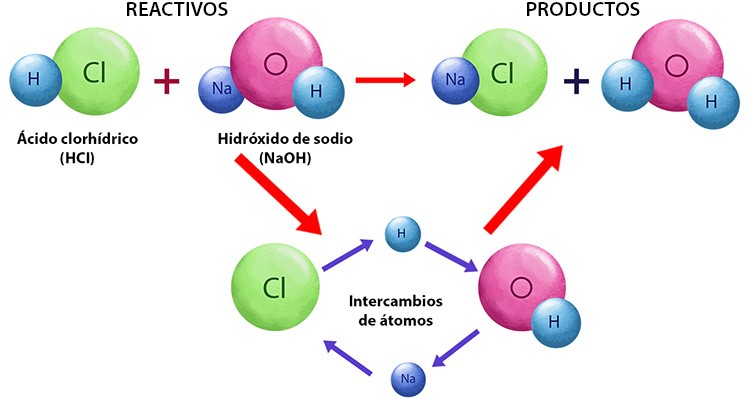
Una reacción química se produce cuando las sustancias participantes en ella se transforman en otras distintas. A las primeras se les llama reactivos y a las segundas productos. La masa de las sustancias participantes es la misma antes y después de la reacción, es decir, se conserva. Esto sucede porque sólo se lleva a cabo un reordenamiento entre los átomos de los reactivos, que se rompen y forman nuevos enlaces.
Una ecuación química es una forma resumida de expresar, mediante símbolos y fórmulas, una reacción química. En ella determinamos las sustancias reaccionantes, se predicen los productos y se indican las proporciones de las sustancias que participan en la reacción.
Para identificar si ha ocurrido una reacción química es necesario verificar si se ha dado alguno de los siguientes eventos:
- Se produce una efervescencia (producción de gases).
- Se libera o absorbe energía (cambia la temperatura del matraz o recipiente donde ocurre la reacción).
- Cambio de color de los reactivos participantes.
- Aparece un precipitado o sustancia insoluble
En esta tabla aparecen los símbolos más utilizados en las ecuaciones químicas. Observa que las sustancias que actúan como reactivos se escriben del lado izquierdo de la reacción mientras que los productos (sustancias que se forman durante una reacción química) del lado derecho.
- (s) = sólido.
- (metal) = elemento metálico.
- (l) = líquido.
- (g) = gas.
- (aq) = disolución acuosa (en agua)
Factores que afectan la velocidad de reacción
Artículo principal: velocidad de raccion
- Naturaleza de la reacción: Algunas reacciones son, por su propia naturaleza, más rápidas que otras. El número de especies reaccionantes, su estado fisico las partículas que forman solidos se mueven más lentamente que las de gases o de las que están en solucion, la complejidad de la reacción, y otros factores pueden influir enormemente en la velocidad de una reacción. Por ejemplo, la reacción de los metales acalinos con sustancias como el oxigeno o el agua es inmediata al ser los primeros mencionados bastante reactivos.
- consentracion: La velocidad de reacción aumenta con la concentración, como está descrito por la ley de concentracion y explicada por la teoria de coliciones . Al incrementarse la concentración de los reactantes, la frecuencias de colicion también se incrementa.
- presion: La velocidad de las reacciones gaseosas se incrementa muy significativamente con la presión, que es, en efecto, equivalente a incrementar la concentración del gas. Para las reacciones en fase condensada, la dependencia en la presión es débil, y solo se hace importante cuando la presión es muy alta.
- orden: El orden de la reacción controla cómo afecta la concentración (o presión) a la velocidad de reacción.
- temperatura: Generalmente, al llevar a cabo una reacción a una temperatura más alta provee más energía al sistema, por lo que se incrementa la velocidad de reacción al ocasionar que haya más colisiones entre partículas, como lo explica la teorias de coliciones . Sin embargo, la principal razón porque un aumento de temperatura aumenta la velocidad de reacción es que hay un mayor número de partículas en colisión que tienen la energia de activavion necesaria para que suceda la reacción, resultando en más colisiones exitosas. La influencia de la temperatura está descrita por la ecuacion de arehnius . Como una regla de cajon , las velocidades de reacción para muchas reacciones se duplican por cada aumento de 10 en la temperatura, aunque el efecto de la temperatura puede ser mucho mayor o mucho menor que esto. Por ejemplo, el carbón arde en un lugar en presencia de oxígeno, pero no lo hace cuando es almacenado a temperatura hambiente . La reacción es espontánea a temperaturas altas y bajas, pero a temperatura ambiente la velocidad de reacción es tan baja que es despreciable.








